
胃癌是全球范围内发病率和死亡率均位居前列的恶性肿瘤,晚期患者预后差,寻找新的治疗靶点迫在眉睫。细胞自噬在癌症中的作用复杂且具有“双刃剑”效应,其在胃癌中的具体调控机制尚不完全清楚,限制了相关治疗策略的开发。近年来,研究发现原本负责嗅觉感知的嗅觉受体(ORs)在多种癌症中异常表达并发挥功能,为肿瘤研究提供了全新视角。
近日,山东大学基础医学院/齐鲁医院病理科高鹏教授团队在国际权威期刊《Cell Death & Differentiation》 上发表了题为 “OR2T6 modulates autophagy through the PPP3CA-mediated pathways to suppress gastric cancer” 的研究论文。该研究首次系统揭示了嗅觉受体OR2T6在胃癌中作为抑癌基因的功能,并阐明了其通过独特地“启动并阻断”自噬过程,以及抑制细胞增殖的双重机制,为胃癌的预后判断和靶向治疗提供了新的潜在靶点。
核心发现:
1. OR2T6是胃癌的独立预后标志物:研究发现,OR2T6在胃癌组织中表达显著低于癌旁正常组织,且其低表达与淋巴结转移、高TNM分期、远处转移等不良临床病理特征密切相关,是预测患者总生存期和无病生存期缩短的独立危险因素。
2. OR2T6抑制增殖并诱导独特的“自噬压力”:功能实验表明,OR2T6能显著抑制胃癌细胞在体外和小鼠体内的增殖。机制上,OR2T6一方面能启动自噬(自噬体形成增加),另一方面却通过损害溶酶体功能,阻断了自噬流的最终降解步骤,导致自噬体异常累积,这种“不完全的自噬”状态对癌细胞造成了生存压力。
3. 揭示OR2T6作用的核心机制:绑定并激活PPP3CA:通过蛋白质相互作用筛选,研究团队发现OR2T6能够特异性结合蛋白磷酸酶PPP3CA。OR2T6不仅通过抑制泛素-蛋白酶体降解途径来稳定PPP3CA蛋白,还通过其GPCR特性,激活Gs/cAMP/PKA信号轴,促进钙离子内流,从而显著增强PPP3CA的酶活性。
4. 阐明下游信号通路:抑制AKT/mTOR与破坏溶酶体功能:
4.1.抑制增殖与启动自噬:激活的PPP3CA通过去磷酸化作用抑制AKT/mTOR信号通路,该通路是细胞增殖的关键促进因子和自噬的经典抑制通路。这一机制直接介导了OR2T6引起的增殖抑制和自噬起始。
4.2阻断自噬流:OR2T6/PPP3CA轴能促进溶酶体生物合成关键转录因子TFEB的核转位。然而,进入细胞核的TFEB并未正常激活溶酶体相关基因(如LAMP1, CTSD等)的转录,反而导致其表达下调,最终引起溶酶体功能障碍,从而阻断了自噬流。
研究意义与展望:
本研究首次将嗅觉受体OR2T6与胃癌的发生发展联系起来,描绘了OR2T6-PPP3CA-AKT/mTOR/TFEB这一全新的信号轴,阐明了OR2T6通过同时“操控”自噬起始和降解两个“开关”来发挥抑癌功能的精细机制。这不仅深化了对胃癌中自噬调控网络的理解,也揭示了代谢感受(嗅觉受体)与细胞稳态(自噬)在癌症中的新型交叉对话。
此外,研究发现OR2T6表达能增强胃癌细胞对自噬抑制剂氯喹的敏感性,提示针对OR2T6相关通路的干预(如激活OR2T6或模拟其功能)可能成为胃癌治疗的新策略,或能与现有疗法(包括自噬抑制剂)产生协同效应。
该研究由山东大学高鹏教授和张慧副研究员作为共同通讯作者指导完成,闫丽萍和朱文洁为共同第一作者。研究工作得到了国家自然科学基金等项目的资助。
论文链接: https://www.nature.com/articles/s41418-025-01611-7
图示摘要: OR2T6通过结合并激活PPP3CA,一方面抑制AKT/mTOR通路以阻断增殖并启动自噬,另一方面引起TFEB功能异常的核转位导致溶酶体功能障碍,从而阻断自噬流,最终抑制胃癌进展。
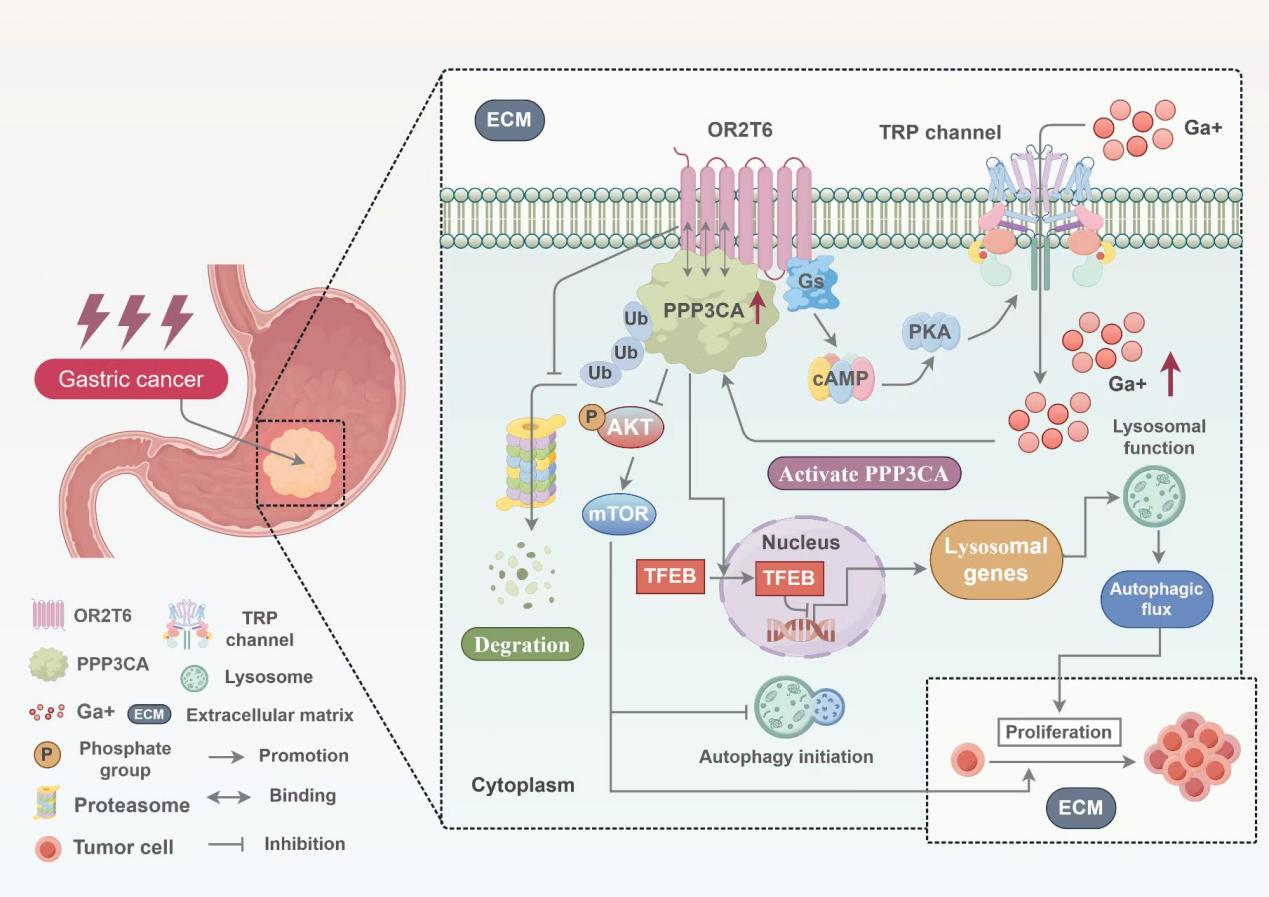
OR2T6调控PPP3CA介导的自噬通路在胃癌中的作用机制图